 Toen in de loop van de vorige eeuw er steeds meer belangstelling kwam voor het klimaat, kwamen er royale fondsen vrij om de ijskernen van Groenland en Antarctica te bestuderen op het klimaat van het verleden. Een belangrijk hulpmiddel daarvoor is de zogenaamde isotopenthermometer.
Toen in de loop van de vorige eeuw er steeds meer belangstelling kwam voor het klimaat, kwamen er royale fondsen vrij om de ijskernen van Groenland en Antarctica te bestuderen op het klimaat van het verleden. Een belangrijk hulpmiddel daarvoor is de zogenaamde isotopenthermometer.
Hoe werkt deze? Zuurstofatomen hebben meestal een kern met atoomgewicht 16, aangeduid als het isotoop 16O, maar één op de vijfhonderd heeft atoomgewicht 18, het isotoop 18O. Ook waterstof kent twee stabiele isotpen: 1H en 2H, de laatste ook wel deuterium (D) genoemd, maar daar gaan we even omheen. Watermoleculen kunnen dus ook lichter of zwaarder zijn al naar gelang het gewicht van de isotopen. Normaal water is dan H216O; zwaar water is H218O. [Wegens beperkingen van het opmaakprogramma wordt de lezer verzocht de sub- en superscripten er zèlf bij te fantaseren.]
Hoewel de chemische eigenschappen identiek zijn, de natuurkundige eigenschappen verschillen licht. Zwaar water heeft een hoger vriespunt en kookpunt.
In het midden van de vorige eeuw bedacht de Deen Willi Dansgaard dat deze verschillen wel eens gebruikt konden worden om temperaturen uit het verleden te reconstrueren uit sneeuw en ijs. Bij de verdamping gaan de lichtere moleculen het eerst en de zwaardere treuzelen wat meer. Bij condensatie is het andersom. De zware jongens klitten eerder bij elkaar dan de lichtere. Zo werd de samenstelling van regen en sneeuw minutieus geanalyseerd op isotopen en het leek erop dat in de poolgebieden en een duidelijke correlatie was tussen isotoopverhoudingen (aangeduid met δ18O) en seizoenstemperaturen. Met die hypothese onder de arm togen de climatici naar de Groenlandse ijskap voor een klimaatreconstructie uit het verleden en wat ze vonden was niet mals.
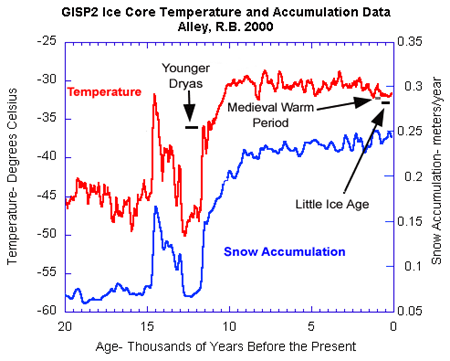
Een periode die al een tijdje in de gaten werd gehouden, wegens verdenking van ernstige koude was het Jonge Dryas, genaamd naar het Arctische bloemetje Dryas octopetala, Die zaak leek ineens helemaal rond te zijn:
Zie afbeelding boven. Bron: Alley 2000.
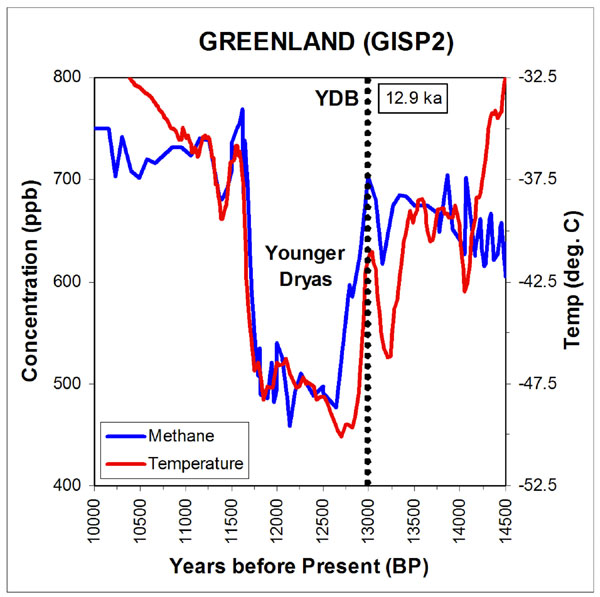
Nog ontstellender was dat de methaanconcentraties extreem correleerden met de isotooptemperaturen. Overigens werden ook soortgelijke isotoopreconstructies gemaakt uit druipsteengrotten en sedimenten op de bodem van meren en zeeën. Het vonnis van het IPCC was duidelijk, rommel een beetje met methaan en je hebt zomaar binnen een paar jaar een ontstellende ‘global warming’. De bron van ’tipping points’, ‘abrupt climate change’ en ’15 F degrees within a decade’. Hoe alarmistisch kun je het hebben?
Als echter de zaak zo eenvoudig lag, dan moet de verschrikkelijke koude van het Jonge Dryas toch ook uit andere bronnen blijken? Daar gaan we in deel twee verder op in.






@ ‘Normaal water is dan H216O; zwaar water is H218O. ‘
Nee, in de gegeven aanduidingen zou dat moeten zijn 1H1H16O voor normaal water en 2H2H16O voor wat gewoonlijk als ‘zwaar water’ wordt aangeduid (11% zwaarder dan normaal water). Het zwaar water dat in bepaalde typen kerncentrales kan worden gebruikt.
Bij de delta-18O gaat het niet om het klassieke ‘zwaar water’, maar om discriminatie bij condensatie en verdamping tussen 1H1H16O (normaal water) ten opzichte van 1H1H18O, toevallig ook 11% zwaarder water, maar geen klassiek ‘zwaar water’. Regenwater en sneeuw bevatten door dit massaverschil, afhankelijk van de temperatuur, wat meer van het lichtere 1H1H16O dan zeewater, en zo ook de neergevallen sneeuw op bijvoorbeeld Groenland, of het grondwater op het vaste land.
Dank je wel Paul voor de correctie, orgineel had ik het met super- en subschriften aangeleverd maar de software was weerbarstig.